MADDE VE ENDÜSTRİ
MADDE VE ENDÜSTRİ
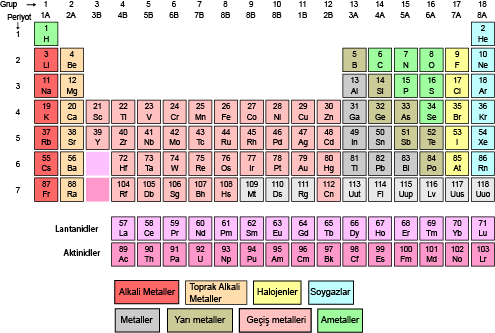
Peryodik Tablo
Tarihi:
Yapısında tek cins atom bulunduran saf maddelere element denir. Günümüzde doğada bulunan element sayısı 90 civarındadır. Yapay elementlerle birlikte bu sayı günümüzde 118’dir. Elementlerin fiziksel ve kimyasal özelliklerindeki benzerliklerin fark edilmesi sınıflandırma çalışmalarını ortaya çıkarmıştır. Bilim insanları elementleri benzer özelliklerine göre gruplandırmışlardır. Bu çalışmaların sonucunda birçok element tablosu yani periyodik sistem(periyodik tablo) oluşmuştur. Elementlerin sınıflandırılmasının tarihsel gelişiminde Ateş, Toprak, Su, Hava gibi betimlendiği olsa da yakın tarihimizde aşağıdaki gibi olmuştur.
Günümüzde:
Modern periyodik cetvelde elementler artan atom numaralarına göre sıralanmıştır. Yatay satırlar( periyot), düşey sütunlar( gruplar) halinde düzenlenmiştir.
Periyodik cetvelde 7 periyot bulunur: 1. periyotta 2, 2. ve 3. periyotta 8, 4. periyotta 18, 5. periyotta 18, 6. periyotta 32 element bulunmaktadır. 7. periyot daha tamamlanmamıştır. 6. ve 7. periyodun 14 er elementi cetvelin altına yerleştirilmiştir. Bunlara Lantanitler ve aktinitler denmiştir.
Gruplar ise A ve B olmak üzere 2 türdür. 8 tane A ve 10 tane B grubu bulunmaktadır. Aynı gruptaki atomların kimyasal özellikleri benzerdir. Grupların bazılarının özel adları vardır. 1A grubu alkali metaller, 2A toprak alkali metaller, 3A grubu toprak metali, 4A grubu karbon grubu, 5A grubu azot grubu, 6A grubu oksijen grubu, 7A grubu halojenler, 8A grubu soygazlar ve B grupları geçiş metalleri şeklindedir.
PERİYODİK CETVELİN İSTİSNALARI;
- 1A grubunda hidrojen atomu hariç diğer atomlar metaldir.
- 1. Periyot hariç diğer periyotlar alkali metalle başlar.
- 3A grubundaki Bor(B) ametal özelliği gösterir.
- 7A grubunda ki Flor (F) yaptığı bileşiklerde sadece-1 değerlik alır.
- 8A grubunda ki helyum atomunun değerlik elektron sayısı 2 iken diğer atomların ki 8 dir.
- 7. Periyot hariç diğer periyotlar soygazla biter.
- Helyum hariç diğer soygaz atomlarından önce bir halojen atomu gelir.
- Geçiş metalleri 4.periyottan itibaren başlar.
| Soldan sağa doğru gidildikçe; | Yukarıdan aşağıya doğru gidildikçe; | |
|---|---|---|
| Atom Numarası | artar | artar |
| Kütle Numarası | artar | artar |
| Atom Çapı (hacmi) | küçülür | artar |
| Metalik Özellik | azalır | artar |
| Ametalik Özellik | artar | azalır |
| Proton Sayısı | artar | artar |
| Değerlik Elektron Sayısı | artar | değişmez |
| Elektron Verme İsteği | azalır | artar |
| Elektron Alma İsteği | artar | azalır |
Elementlerin Sınıflandırılması
Metaller:
- Periyodik tablonun sol tarafında yer alırlar. Dikkat! Sol tarafta bulunan tek ametal hidrojendir.
- Oda sıcaklığında cıva hariç hepsi katı haldedir.
- Erime ve kaynama noktaları yüksektir.
- Elektirik ve ısıyı iyi iletirler.
- Elektronu sevmeyip hemen kurtulmak isterler. Kararlı hale geçmek için bileşiklerinde genellikle elektron veririler.
- Bileşiklerinde daima pozitif yüklü iyon(katyon) oluştururlar.
- Sadece ametallerle bileşik oluşturabilirler.
- Kendi aralarında bileşik oluşturamazlar.
- Kendi aralarında pirinç, çelik, bronz gibi homojen karışımlar olan alaşımları oluştururlar.
- Parlaktırlar, Işığı yansıtırlar.
- Doğada atomik yapıda bulunurlar.
- Tel ve levha haline gelebilirler.
Ametaller:
- Periyodik tablonun sağ tarafında yer alırlar.
- Oda sıcaklığında katı, sıvı ve gaz halde bulunabilirler.
- Elektrik ve ısıyı iletemezler. (Grafit hariç)
- Kararlı hale geçmek için bileşiklerinde genellikle elektron alma eğilimindedirler.
- Bileşiklerinde genellikle negatif yüklü iyon (anyon) oluştururlar.
- Kendi aralarında molekül yapılı, metallerle iyonik yapılı bileşik oluştururlar.
- Mattırlar.
- Doğada molekül yapılı olarak bulunurlar.
- Kırılgan olduklarından tel ve levha haline getrilemezler.
Soygazlar:
- Periyodik tablonun en sağında 8A grubunda yer alırlar.
- Tamamı gaz haldedir.
- Erime ve kaynama noktaları düşüktür.
- Hiç bir şekilde her hangi bir elementle tepkimeye girmezler. Çünkü kararlı yapıdadırlar. Katyon anyon oluşturmazlar.
- Kokusuz ve renksizdirler.
Yarı metaller:
- Tel ve levha haline getirilebilirler.
- Isı ve elektriği ametallerden iyi, metallerden kötü iletirler.
- Oda koşullarında katıdır.
- Parlak ya da mat görünümdedir.
FİZİKSEL VE KİMYASAL DEĞİŞİMLER
| FİZİKSEL DEĞİŞİM | KİMYASAL DEĞİŞİM |
|---|---|
|
|
| Hangi Olaylarda Görülür? | Hangi Olaylarda Görülür? |
|
|
Kimyasal değişimle beraber, fiziksel değişmede gözlenir. Kağıt yandığında kağıt artık kağıt özelliği göstermez. Yeni maddeler oluşur. Kağıt ve oluşan külün de fiziksel özellikleri farklıdır.
KİMYASAL TEPKİMELER
Maddelerin kimyasal değişime uğrayarak yeni maddeler oluşturmasına kimyasal tepkime denir. Kimyasal tepkimelerde ısı, ışık, gaz çıkışı, renk değişimi, çökelek oluşumu ve hal değişimi meydana gelebilir. Fakat bu tür değişimler her zaman kimyasal değişim olduğunun kanıtı olamaz. Bazı durumlarda fiziksel değişimlerde de aynı ipuçları görülmektedir.
Elementlerin kararlı hale geçme istekleri:
Elementler kararlı hale geçebilmek için en yakın soy gaza benzemek isterler. Bunun için de elektron alır ya da elektron verirler.1A, 2A ve 3A grubu elementleri (metaller) elektron vererek kararlılığa ulaşır. 5A, 6A, 7A grubu elementleri(ametaller) ise elektron alarak soy gazlara benzerler. Burada önemli olan atomun son yörüngesindeki elektron sayısını tamamlamasıdır. Bir atomda birinci yörünge maksimum 2, ikinci yörünge maksimum 8 elektron alabilir. Son yörüngedeki elektron sayılarını kararlı hale getirmek(soy gazlara benzemek) için başka bir atomla elektron alış verişi yapabilir ( iyonik bağ kurma durumu) ya da başka bir atomla elektronları ortak kullanabilir ( kovalent bağ kurma durumu).
İyon oluşumu: Pozitif veya negatif yükü olan bir atoma ya da atomlar grubuna iyon denir. Son yörüngesinde 1, 2 ve 3 elektron bulunduran atomlar elektron vermeye yatkındırlar. Elektron verdiklerinde (+) değerlik alarak katyon oluştururlar. (Helyum hariç Soygaz olduğu için ) Son yörüngesinde 5,6 ve 7 elektron bulunduranlar elektron almaya yatkındırlar. Elektron aldıklarında (–) değerlik alarak anyon oluştururlar. Bir atom son yörüngesindeki elektron sayısını 2’ye tamamlayarak soy gaza benzer ise bu duruma Dublet Kuralı denir. Bir atomun son yörüngesindeki elektron sayısını 8’e tamamlayarak soy gaza benzemesine ise Oktet Kuralı denir.
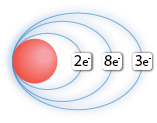
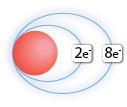
Örneğin; Al ⇒ Al+3 + 3e- Durumuna baktığımızda Alüminyum atomu 3 elektronunu vererek katyon iyonu oluşturmuştur. Normal halde 13 elektronu bulunan Alüminyum atomunun birinci yörüngesinde 2e- ikinci yörüngesinde 8e- ve üçüncü yörüngesinde 3e- bulunurken iyon haline geçtiğinde son yörüngesindeki 3 e- 'nu kaybederek kararlı hale geçer.
| Al Atomu | Al+3 İyonu |
|---|---|
 |
|
Bileşik Formüllerinin Yazılması
İyonik bağlı bileşiklerde daima anyon ve katyon olan iki madde bir araya gelerek bileşik oluşturur. Basit olarak bir örnek verecek olursak Li+ katyonu O-2 anyonu ile bileşik oluşturduğunda Oksijenin 2 elektronunu vereceği iki tane Lityum atomuna ihtiyaç duyar çünkü Lityum sadece bir elektron ihtiyacına sahiptir. Oluşacak bileşik Li2O (lityum oksit) olacaktır.
Li+ ve O-2 ⇒ Li2O
Bir atomun iyon durumunu bilmenin en kolay yöntemi periyodik tablodaki yerini bilmektir. 1A grubu ( Hidrojen hariç ) genellikle +1 değerlikle katyon oluşturur. (Li+, Na+, K+ gibi...) 2A grubu genellikle +2 değerlikle katyon oluşturur. (Be+2, Mg+2, Ca+2 gibi... ) Ametaller sınıfına geçildiğinde ise atom elektron vermektense elektron almanın son yörüngeyi daha kolay kararlı hale getireceğinden elektron almayı tercih eder. 7A Grubu elementleri genellikle -1 değerlilik alarak anyon oluşturur. (Fl-, Cr-, Br- gibi..) 6A Grubu elementleri genellikle -2 değerlilik alarak anyon oluşturur. (O-2, S-2, Se-2 gibi... )
Karşımıza NaOH gibi bir bileşik çıkması durumunda bazı çok atomlu iyonları bilmek durumundayız. Bu bileşikte çok atomlu iyonumuz OH-(hidroksit) iyonudur. Na+ iyonu ile OH- çok atomlu iyonu bir araya gelmiştir.
Na+ ve OH- ⇒ NaOH
Yaygın Görülen Çok Atomlu İyonlar;
|
Hg2+2 |
|---|
Aşağıdaki durumlara dikkat edelim;
Al1durumunda alttaki 1 yazılmaz. Atta bir rakam yoksa biz onu 1 olarak kabul ederiz.- NO3 durumunda 3 oksijen ve 1 azot olmasına karşın Al(NO3)3 durumunda 9(3X3) oksijen 3(1X3) tane azot (N) bulunur.
KİMYASAL BAĞLAR
Kararlı olmayan atomların kararlı hale benzemek için elektron alarak veya vererek ya da elektronlarını ortaklaşa kullanarak oluşturdukları bağa kimyasal bağ denir. Atomlar arasında iyonik ve kovalent bağ olmak üzere iki tür kimyasal bağ oluşur.
| İyonik Bağ | Kovalent Bağ |
|---|---|
| Metal ve ametal atomları arasında oluşur.
Elektron alışverişi gerçekleşir. Elektron veren metal pozitif yüklü iyon (katyon) haline; elektron alan ametal negatif yüklü iyon (anyon) haline gelir. Anyon ve katyon zıt yüklü olduğu için aralarında bir çekim gücü oluşur. İyonik yapı atom yığını ( kristalize ) şeklindedir. İyonik bağlı bileşikler suda iyonlarına ayrışır. İyonik bağlı bileşikler elektrik akımını iletir. Not: Metal atomları sadece iyonik bağ oluştururlar. |
Aynı veya farklı tür ametal atomları arasında oluşur.
Elektron ortaklaşması gerçekleşir. Sadece son katmalardaki elektronlar ortaklaşa kullanılır. Ortaklaşa kullanılan elektronlar, bağ oluşturan atomların katmanlarında dolaşır. Kovalent bağlı bileşikler molekül yapılıdırlar. Sulu çözeltileri elektrik akımını iletmez Not: Ametal atomları hem iyonik hem kovalent bağ oluşturabilir. |
Kimyasal Tepkimelerin Özellikleri
- Madde özelliklerini kaybeder yeni madde oluşur.
- Kimyasal özellikler değişir.
- Atomlar arasındaki kimyasal bağlar kopar.
- Kimyasal tepkimeye giren atomların türü ve sayısı değişmez.
- Kimyasal tepkimeler sırasında madde moleküllerindeki atomları veya iyonları bir arada tutan bağlar kırılır(kopar) ve yeniden düzenlenerek yeni bağlar oluşur.
- Bileşikler kimyasal tepkimeler sonucunda oluşur.
- Canlılarda büyüme, sindirim, solunum, fotosentez gibi olaylar kimyasal tepkimeler sonucu gerçekleşir.
- Kimyasal tepkimeye giren maddenin kütlesi ile ürünleri kütleleri eşittir.
- Girenlerin ve ürünlerin molekül sayısı ve hacimleri korunmayabilir.
Kimyasal Tepkimelerin Yazılması
Kimyasal tepkimeye giren maddeler kimyasal denklemin sol tarafına yazılır ve girenler olarak adlandırılır. Kimyasal tepkime sonucu oluşan maddeler ürün olarak adlandırılır ve kimyasal denklemin sağ tarafına yazılır. Kimyasal tepkimeye birden fazla madde girdiyse giren maddelerin aralarına (+) işareti konur. Aynı durum ürünler için de söz konusudur. Tepkime sonunda birden fazla ürün oluştuysa aralarına (+) işareti konur. ( → ) işareti ise tepkimeye giren maddelerin hangi ürünleri oluşturduğunu göstermek için kullanılır.
GİRENLER → ÜRÜNLER şeklinde oluşacaktır.
KİMYASAL TEPKİMELERİN DENKLEŞTİRİLMESİ
Kimyasal tepkimelere giren maddelerle çıkan maddeleri oluşturan atomların cinsleri ve sayıları aynıdır. Dolayısıyla bir tepkime denkleminin sol ve sağ tarafında aynı cins ve aynı sayıda atom bulunmalıdır. Böyle tepkime denklemlerine denkleştirilmiş tepkime denklemi adı verilir. Eğer bir tepkime denklemi denk değilse, formül ve sembollerin önüne uygun sayılar yazılarak tepkime denkleştirilir.
| DEĞİŞEBİLENLER | DEĞİŞMEYENLER |
|---|---|
| Toplam Molekül Sayısı
Fiziksel Haller Atomların Elektron Düzeni Atomların Elektron Sayısı Fiziksel Özellikler |
Atom Sayısı ve Cinsi
Toplam Kütle Toplam Proton Sayısı Toplam Elektron Sayısı Toplam Nötron Sayısı |
Denkleştirmede dikkat edilmesi gerekenler;
- Denk olmayan atom sayılarının başına kat sayıları yazılarak denkleştirilir.
- Bileşiğin yapısal formülündeki rakamlar değiştirilmez!
- Denkleştirmenin en basit yolu atom sayısı ve çeşidi en fazla bileşiğin katsayısını 1 vermektir. Gerekirse onun da katsayısı değişebilir.
- Hidrojen ve Oksijen atomlarına en son bakılır.
- Bileşiklerin başına kesirli sayı getirilmez. (HCl, BaCl2, H2 CO3 ...)
- Molekül halindeki elementlerin başına kesirli sayı getirilebilir. ( H2, N2, O2 )
Örnek: Fe+O2 → Fe2O3 denklemini inceleyelim.
İlk olarak bakmamız gereken girenler ve ürünlerin ne olduğudur. Burada 1 adet Fe atomu ve 2 tane O atomundan oluşan O2 bileşiği tepkimeye giriyor ve 2 adet Fe, 3 Adet O'den oluşan Fe2O3 (demir oksit) tepkime sonucu oluşuyor.
Oksijen ve hidrojen sona bırakılır o yüzden ilk olarak Fe atomuna bakmalıyız. Bir adet girip 2 adet çıkamayacağı için girenler kısmındaki Fe atomunun başına 2 yazarsak tepkimeye 2 adet Fe sokmuş oluruz. Denklemimiz şu şekli alacaktır;
2Fe+O2 → Fe2O3
Tepkimede olan ikinci atomumuz oksijene baktığımızda 2 adet tepkimeye girmiş fakat 3 adet çıkmış görünmektedir. bu durum söz konusu olamayacağından O2 nin başına 3/2 koymamız gerekecek ve tepkimeye giren oksijen sayısını 3 e çıkarmış olacağız. Böylelikle girenlerde ve ürünlerde eşit sayıda oksijen olmuş olacaktır. Denklemimizin son hali;
2Fe+3/2 O2 → Fe2O3 şeklinde olacaktır.
Kimyasal tepkimeye giren maddelerin toplam kütlesi ile tepkimeden çıkan maddelerin toplam kütleleri birbirine eşittir. Buna kütlenin korunumu kanunu denir. Bir başka değişle madde vardan yok olmaz, yoktan da madde var edilemez.
YANMA TEPKİMESİ
Bir maddenin oksijenle (O2) tepkimeye girmesine yanma denir. Yanma tepkimeleri her zaman çevreye ısı enerjisi yayar ve kendiliğinden devam eder. Bir yanma tepkimesi için; Yanıcı madde, Oksijen (hava) ve Tutuşma Sıcaklığı gerekir. Havasız (O2’siz) ortamda yanma olmaz. Bu nedenle yanan bir maddeyi söndürmek için önce hava ile teması kesmek gerekir. Tüm yanma olayları odunun veya kağıdın yanması gibi bir anda veya alev çıkararak gerçekleşmez. Demirin veya metallerin paslanması da bir yanma olayıdır. Fakat bu olay yavaş yanma adını alır. Aynı zamanda bu olaya oksitlenme de denir. Yanma tepkimeleri sonucu genelde açığa CO2 (karbondioksit) ve su açığa çıkar.
ASİT VE BAZLAR
Maddeler kimyasal özellikleri bakımından üç gruba ayrılır. Bunlar; asitler, bazlar ve asitlik ve bazlık bakımından nötr olan maddelerdir.
ASİTLER
Asitler suda çözündüğünde hidrojen iyonu derişimini arttıran maddelerdir. Hidrojen iyonları çözeltiyi asidik yapar.
Asitlerin Özellikleri;
- Sulu çözeltilerinde H+ iyonu (hidrojen iyonu) verirler.
- Tatları ekşidir.
- Ciltte yanma hissi uyandırırlar. Kuvvetli bir asitse cildi tahriş eder.
- Mavi turnusol kâğıdını kırmızıya çevirirler.
- Sulu çözeltileri elektrik akımını iletir.
- Asitler mermer ve metal yüzeyleri aşındırır. Metal ile tepkimeye girerek H2 gazı açığa çıkarır.
- Asitler, bazlar ile tepkimeye girerek tuz ve su oluştururlar. Buna nötrleşme tepkimesi denir.
Yapısında H (Hidrojen) atomu bulunduran her madde asit değildir. Su (H2O), Amonyak (NH3), Metan gazı (CH4) gibi. Bazı maddeler yapısında ise hidrojen bulunmadığı halde, sulu çözeltilerinde hidrojen iyonu (H+)oluşumuna sebep oldukları için asit özelliği gösterirler. Karbondioksit (CO2), Azot dioksit (NO2) ve Kükürt dioksit (SO2) suda asit özelliği gösteren maddelerdir.
| Formülü | Okunuşu | Suda Çözüldüğünde
Oluşan İyonlar |
Piyasa Adı | Kullanıldığı Yerler |
|---|---|---|---|---|
| HCl | Hidroklorik Asit | H+ ve Cl- | Tuz Ruhu | Temizlik ürünü |
| H2SO4 | Sülfürik Asit | H+ ve SO4-2 | Zaç Yağı | Patlayıcı madde, boya, ilaç ve akü |
| HNO3 | Nitrik Asit | H+ ve NO3- | Kezzap | Patlayıcı madde , gübre ve temizlik ürünü |
| H2CO3 | Karbonik Asit | H+ ve HCO3- | Gazoz Asidi | Gazoz (yağmur suyunda da bulunur.) |
| H3PO4 | Fosforik Asit | H+ ve PO4-3 | Kola Asidi | İlaç, yağ sanayi, sinek ilacı, gıda koruyucu, kola ve temizlik ürünü |
| CH3COOH | Asetik Asit | H+ ve CH3COO- | Sirke | Yemek sektörü |
| HCOOH | Formik Asit | H+ ve HCOO- | Karınca Asidi | koruyucu ve anti bakteriyel alan, deri işleme |
| BAZI YİYECEK VE İÇECEKLERİMİZDEKİ ASİTLER; |
|---|
|
ELMA |
BAZLAR
Baz, suda iyonlaştıklarında ortama OH− (hidroksit) iyonu verebilen maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Suda iyonlaştıklarında hidroksit (OH−) iyonu derişimini arttıran maddelere baz denir.
Bazların Özellikleri;
- Sulu çözeltilerinde OH- (hidroksit) iyonu verirler.
- Tatları acıdır.
- Cilde kayganlık hissi verir.
- Kırmızı turnusol kâğıdını maviye çevirirler.
- Sulu çözeltileri elektrik akımını iletir.
- Metallerle tepkimeye girmemeleri asitlerden ayırmak için kullanılabilir.
- Bazlar; cam, kristal ve porselenleri matlaştırır.
- Bazlar, asitler ile tepkimeye girerek tuz ve su oluştururlar. Buna Nötrleşme tepkimesi denir.
| Formülü | Okunuşu | Suda Çözüldüğünde
Oluşan İyonlar |
Piyasa Adı | Kullanıldığı Yerler |
|---|---|---|---|---|
| NaOH | Sodyum hidroksit | Na+ ve OH- | Kostik | Sabun, lavabo açıcı. |
| KOH | Potasyum hidroksit | K+ ve OH- | Potas Kostik | Arap sabunu, sıvı sabun, şampuan. |
| Ca(OH)2 | Kalsiyum hidroksit | Ca+2 ve OH- | Sönmüş Kireç | Sıva ve harç. |
| Mg(OH)2 | Magnezyum hidroksit | Mg+2 ve OH- | Antiasit | |
| NH3 | Amonyak | NH4+ ve OH- | Amonyak | Ev temizlik malzemesi, gübre, patlayıcı madde |
| LiOH | Lityum Hidroksit | Li+ ve OH- | Pil, Seramik, Cam |
| GÜNLÜK HAYATTA BAZ İÇEREN BAZI MADDELER; |
|---|
|
SABUN DİŞ MACUNU ACI BİBER KABARTMA TOZU ÇİKOLATA KÜL |
Asit ve Bazlar birbirine ters gibi görünse de elektriği iletmek, turnusol kağıdına etki etmek, nötrleşme tepkimesine katılmak gibi ortak yönleri vardır.
BELİRTEÇ (İNDİKATÖR) MADDELER:
pH belirteçleri (İndikatörler), çözeltinin pH'sına bağlı olarak renk değiştiren, karmaşık yapıdaki organik bileşiklerdir. Asidik ve bazik özellik gösteren maddelerde farklı renk alır. Doğal olarak kullanılan belirteçler de vardır.
| Belirteç | Asite uygulandığında aldığı renk | Baza uygulandığında aldığı renk |
|---|---|---|
| Turnusol Kağıdı | Kırmızı | Mavi |
| Metil Oranj | Kırmızı | Sarı |
| Fenolftalein | Renksiz | Pembe |
| Kırmızı Lahana Suyu | Kırmızı | Mavi |
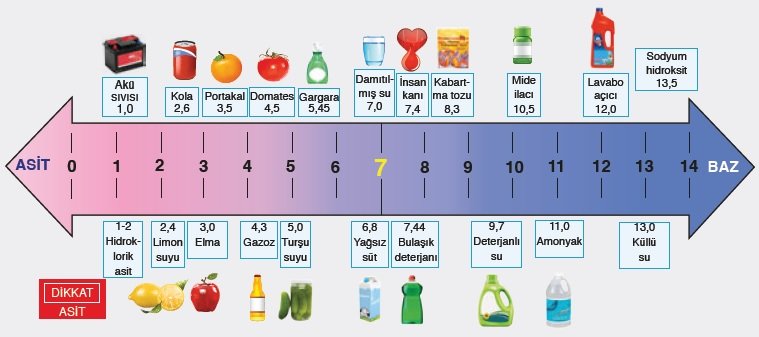
pH ölçeği;
pH ölçeği bir maddenin ne kadar asidik ya da bazik olduğunu belirten ölçektir. 14 birime ayrılmıştır. 0-7 arasındaki değerler asidik, 7 nötr ve 7-14 arası çıkan sonuçlar ise bazik olduğunu gösterir. Farklı bir deyişle çözeltide 0-7 arası H+ iyonları > OH- iyonları, 7 de H+ iyonları = OH- iyonları ve 7-14 arası da H+ iyonları < OH- iyonları denilebilir.
Asit ve Bazların Zararlı Etkisinden Korunma Yolları:
- Mermer tezgahta limon kesmemeliyiz.
- Temizlik sırasında deterjanlı yüzeyleri bol su ile yıkamalıyız.
- Asit ve bazları kullanırken özellikle deterjanların cildimize temasını önlemek için mutlaka eldiven kullanmalıyız.
- Temizlik malzemelerini birbirine rastgele karıştırmamalıyız.
- Labaratuvarda asit ve bazlarla çalışırken mutlaka önlük, koruyucu gözlük ve eldiven kullanmalıyız.
- Herhangi bir kaza anında asit veya bazın temas ettiği bölgeyi bol su ile yıkamalıyız.
- Herhangi bir kaza anında en kısa sürede sağlık kuruluşuna başvurmalıyız.
Asit Yağmuru:
- Fosil yakıtların yanması sonucu CO2, NO2, SO2 gazları açığa çıkar.
- Bu gazlar suda iyonlaşarak H2CO3, HNO3, H2SO4 asitlerini oluşturarak yağmur suyunun asidik özellik oluşturmasına neden olur.
- Oluşan asit yağmuru ormanlara, antik yapılara, şehir yapılarına ve doğaya zarar verir.
- Topraktaki Ca+2 Mg+2 K+ gibi minerallerin çözünmesine neden olarak toprakların verimsizleşmesine neden olur.
- Araçların ve iş makinelerin yüzeyinin aşınmasına neden olur.
- Asit yağmurlarına daha çok hava kirliliği neden olur. Bu yüzden hava kirliliğinin olduğu yerlerde daha sık görülür.
MADDENİN ISI İLE ETKİLEŞİMİ
Enerji doğada farklı şekillerde karşımıza çıkabilir. Isı da bunlardan biridir. Evrendeki bütün enerjilerin kaynağı güneştir, güneş ile dünya arasında ısı alışverişi gerçekleşir ve bu alışveriş toprak, taş, su ve tüm maddelerin ısınmasına neden olur.
Bir maddeyi oluşturan taneciklerin sahip oldukları hareket (kinetik) enerjilerinin toplamına ısı denir. Sıcaklık ise buradaki bütün taneciklerin kinetik enerjilerinin ortalamasıdır.(yaklaşık bir taneciğin kinetik enerjisi)
Sıcaklıkları farklı maddeler arasında sıcaklığı fazla olandan az olana doğru gerçekleşen ısı aktarımına ısı alışverişi denir.
Isı alışverişi maddelerin sıcaklıkları eşitleninceye kadar devam eder. Eşit sıcaklıktaki maddeler arasında ısı alışverişi durur.
| ISI | Sıcaklık |
|---|---|
| Isı bir enerji çeşidi | Sıcaklık ise bir ölçümdür. |
| Isı kalorimetre kabı ile | Sıcaklık termometre ile ölçülür. |
| Isı birimi kalori (cal) veya Joule, | Sıcaklık birimi ise derecedir. |
| Isı, madde miktarına bağlıdır | Sıcaklık ise madde miktarında bağlı değildir. |
ÖZ ISI
Bir maddenin 1 gramının sıcaklığını 1 °C değiştirmek için gerekli olan ısı miktarıdır. Maddenin cinsine göre öz ısısı maddenin ayırt edici bir özelliğidir. Birimi ise cal/g °C ya da J/g °C’tur. Uluslararası birim sisteminde (SI) öz ısı birimi J/g °C olarak kabul edilmektedir.
| Maddenin adı | Öz ısı (Cal/g°C) |
|---|---|
| Su | 1.00 |
| Buz | 0.50 |
| Zeytinyağı | 0.47 |
| Naftalin | 0.41 |
| Hidrojen | 0.41 |
| Oksijen | 0.22 |
| Bor | 0.58 |
Günlük Yaşamda Öz Isı:
- Elektrikli radyatörlerde su yerine yağ kullanılması yağın öz ısısının düşük olmasından kaynaklanır.
- Denizlerin karalardan geç ısınıp geç soğuması, suyun öz ısısının karaların öz ısısından daha fazla olması ile ilgilidir.
- Gündüz vakti, karalar denizden daha çabuk ısınır ve denizden karaya doğru serin rüzgârlar (gündüz meltemi) eser. Akşamları karalar denizlerden daha çabuk soğuduğu için de karadan denize doğru serin rüzgârlar (gece meltemi) eser.
- Yeni pişirilmiş peynirli ve patatesli böreklerden peynirli olan börek, patatesli olan böreğe göre daha çabuk soğur.
- Güneş altında kalan bir arabanın metal kısımlarının sıcaklığı, cam kısmının sıcaklığından fazla olur. Bunun sebebi demirden yapılı metal kısımların öz ısısının camın öz ısısından küçük olmasıdır.
- Aynı evde tahta zeminden fayansa bastığımızda ayağımız daha çok üşür. Bunun nedeni tahtanın öz ısısının fayansın öz ısısından büyük olmasıdır.
- Tavalarda ateşe temas eden metal kısım çabuk ısınırken elle tutulan tavanın sapı çok geç ısınır veya ısınmaz. Bunun sebebi metalin öz ısısının plastiğin öz ısısından küçük olmasıdır.
- Ocakta kaynayan yemeği karıştırmak için kullanılan metal ve tahta kaşıktan metal kaşığın tahta kaşığa göre daha çabuk ısınması metalin öz ısısının tahtadan küçük olmasından kaynaklanır.
Isınmanın Maddenin Cinsine(Öz Isısına), Kütlesine, Sıcaklığa Bağlı Değişimi;
| kırağılaşma |
||||
|---|---|---|---|---|
 Katı |
Erime Donma |
 Sıvı |
buharlaşma yoğuşma |
 Gaz |
süblimleşme | ||||
Hal Değişimi:
Maddelerin hâl değişimine uğrayabilmesi için ısı alması ya da vermesi gerekir. Isı alan katı bir maddenin tanecikleri arasındaki mesafe artar önce sıvı, ısı almaya devam ettiğinde ise gaz hâle geçer. Gaz haldeki bir madde ise ortama ısı verdiğinde tanecikleri arasındaki mesafe azalır önce sıvı daha sonra da katı hâle geçer.
Saf maddeler belirli bir sıcaklık değerlerinde hâl değiştirir. Maddelerin hâl değiştirdiği sıcaklık değerlerine hâl değiştirme sıcaklığı denir. Saf bir maddenin hal değişimi esnasında ısı verilmesine karşın sıcaklık değişmez. Burada verilen ısı enerjisi tanecikler arasındaki mesafenin artması veya azalması için kullanırlar. Erime noktası, donma noktası, kaynama noktası ve yoğuşma noktası maddeler için ayırt edici özelliktir .Aynı madde için erime sıcaklığı, donma sıcaklığına; kaynama sıcaklığı ise yoğuşma sıcaklığına eşittir. Bir maddenin hâl değiştirmesi için gereken ısı miktarı, maddenin kütlesine ve cinsine bağlıdır.
Hal Değişim Isıları: Hal değişim ısıları maddenin ayırt edici özelliğinden biridir. Birimi j/g’dır. Bir gram maddenin hal değişimi için gerekli olan ısı miktarına kal değişim ısısı denir.
Bir maddenin erime ısısı ve donma ısısı, buharlaşma ısısı ve yoğuşma ısısı birbirine eşittir.
Erime Isısı (L0) = Donma Isısı (Ld), Buharlaşma Isısı (Lb)=Yoğuşma Isısı(Ly)