MADDE VE ENDÜSTRİ ÖDEVPEDİA
HAFTALIK OLARAK OKUL PLANINA GÖRE O HAFTA İŞLENEN KONULAR İLE ALAKALI OLARAK HAZIRLANAN ÖDEVPEDİA'YA HER ÇARŞAMBA YENİ BİR SAYFA EKLENMEKTEDİR. SİTEDE VAR OLAN BÜTÜN ÇALIŞMALAR OKUL BİLGİLERİNİ PEKİŞTİRME AMAÇLIDIR. BU NEDENLE ÖNCELİK OKUL DERSLERİ VE ÖDEVLERİ OLMALIDIR!

|
|---|
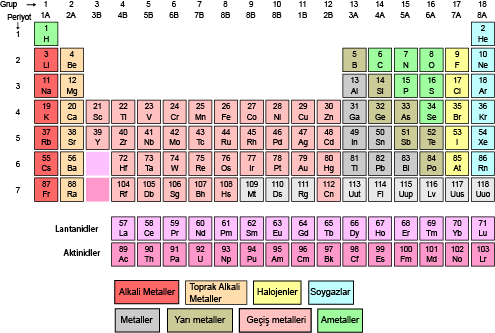
Peryodik Tablo
Tarihi:
Yapısında tek cins atom bulunduran saf maddelere element denir. Günümüzde doğada bulunan element sayısı 90 civarındadır. Yapay elementlerle birlikte bu sayı günümüzde 118’dir. Elementlerin fiziksel ve kimyasal özelliklerindeki benzerliklerin fark edilmesi sınıflandırma çalışmalarını ortaya çıkarmıştır. Bilim insanları elementleri benzer özelliklerine göre gruplandırmışlardır. Bu çalışmaların sonucunda birçok element tablosu yani periyodik sistem(periyodik tablo) oluşmuştur. Elementlerin sınıflandırılmasının tarihsel gelişiminde Ateş, Toprak, Su, Hava gibi betimlendiği olsa da yakın tarihimizde aşağıdaki gibi olmuştur.
Günümüzde:
Modern periyodik cetvelde elementler artan atom numaralarına göre sıralanmıştır. Yatay satırlar( periyot), düşey sütunlar( gruplar) halinde düzenlenmiştir.
Periyodik cetvelde 7 periyot bulunur: 1. periyotta 2, 2. ve 3. periyotta 8, 4. periyotta 18, 5. periyotta 18, 6. periyotta 32 element bulunmaktadır. 7. periyot daha tamamlanmamıştır. 6. ve 7. periyodun 14 er elementi cetvelin altına yerleştirilmiştir. Bunlara Lantanitler ve aktinitler denmiştir.
Gruplar ise A ve B olmak üzere 2 türdür. 8 tane A ve 10 tane B grubu bulunmaktadır. Aynı gruptaki atomların kimyasal özellikleri benzerdir. Grupların bazılarının özel adları vardır. 1A grubu alkali metaller, 2A toprak alkali metaller, 3A grubu toprak metali, 4A grubu karbon grubu, 5A grubu azot grubu, 6A grubu oksijen grubu, 7A grubu halojenler, 8A grubu soygazlar ve B grupları geçiş metalleri şeklindedir.
PERİYODİK CETVELİN İSTİSNALARI;
- 1A grubunda hidrojen atomu hariç diğer atomlar metaldir.
- 1. Periyot hariç diğer periyotlar alkali metalle başlar.
- 3A grubundaki Bor(B) ametal özelliği gösterir.
- 7A grubunda ki Flor (F) yaptığı bileşiklerde sadece-1 değerlik alır.
- 8A grubunda ki helyum atomunun değerlik elektron sayısı 2 iken diğer atomların ki 8 dir.
- 7. Periyot hariç diğer periyotlar soygazla biter.
- Helyum hariç diğer soygaz atomlarından önce bir halojen atomu gelir.
- Geçiş metalleri 4.periyottan itibaren başlar.
| Soldan sağa doğru gidildikçe; | Yukarıdan aşağıya doğru gidildikçe; | |
|---|---|---|
| Atom Numarası | artar | artar |
| Kütle Numarası | artar | artar |
| Atom Çapı (hacmi) | küçülür | artar |
| Metalik Özellik | azalır | artar |
| Ametalik Özellik | artar | azalır |
| Proton Sayısı | artar | artar |
| Değerlik Elektron Sayısı | artar | değişmez |
| Elektron Verme İsteği | azalır | artar |
| Elektron Alma İsteği | artar | azalır |
Elementlerin Sınıflandırılması
Metaller:
- Periyodik tablonun sol tarafında yer alırlar. Dikkat! Sol tarafta bulunan tek ametal hidrojendir.
- Oda sıcaklığında cıva hariç hepsi katı haldedir.
- Erime ve kaynama noktaları yüksektir.
- Elektirik ve ısıyı iyi iletirler.
- Elektronu sevmeyip hemen kurtulmak isterler. Kararlı hale geçmek için bileşiklerinde genellikle elektron veririler.
- Bileşiklerinde daima pozitif yüklü iyon(katyon) oluştururlar.
- Sadece ametallerle bileşik oluşturabilirler.
- Kendi aralarında bileşik oluşturamazlar.
- Kendi aralarında pirinç, çelik, bronz gibi homojen karışımlar olan alaşımları oluştururlar.
- Parlaktırlar, Işığı yansıtırlar.
- Doğada atomik yapıda bulunurlar.
- Tel ve levha haline gelebilirler.
Ametaller:
- Periyodik tablonun sağ tarafında yer alırlar.
- Oda sıcaklığında katı, sıvı ve gaz halde bulunabilirler.
- Elektrik ve ısıyı iletemezler. (Grafit hariç)
- Kararlı hale geçmek için bileşiklerinde genellikle elektron alma eğilimindedirler.
- Bileşiklerinde genellikle negatif yüklü iyon (anyon) oluştururlar.
- Kendi aralarında molekül yapılı, metallerle iyonik yapılı bileşik oluştururlar.
- Mattırlar.
- Doğada molekül yapılı olarak bulunurlar.
- Kırılgan olduklarından tel ve levha haline getrilemezler.
Soygazlar:
- Periyodik tablonun en sağında 8A grubunda yer alırlar.
- Tamamı gaz haldedir.
- Erime ve kaynama noktaları düşüktür.
- Hiç bir şekilde her hangi bir elementle tepkimeye girmezler. Çünkü kararlı yapıdadırlar. Katyon anyon oluşturmazlar.
- Kokusuz ve renksizdirler.
Yarı metaller:
- Tel ve levha haline getirilebilirler.
- Isı ve elektriği ametallerden iyi, metallerden kötü iletirler.
- Oda koşullarında katıdır.
- Parlak ya da mat görünümdedir.
| AŞAĞIDA YER ALAN KAVRAMLARI, VERİLEN CÜMLELERDE BOŞ BIRAKILAN YERLERE UYGUN ŞEKİLDE YERLEŞTİRİNİZ. | 
|
|---|
| Yörünge | Periyot | Geçiş | Meyer | Ametaller | 7 Adet | Moseley | Grup | Proton | Metaller |
|---|
| AŞAĞIDA VERİLEN BİLGİLER DOĞRU İSE "D", YANLIŞ ISE "Y" SEÇENEĞİNİ SEÇİNİZ. | 
|
|---|
|
|
| AŞAĞIDAKİ ÇOKTAN SEÇMELİ SORULARI CEVAPLAYINIZ. | 
|
|---|
| TEST |
|---|
-