MADDE VE ENDÜSTRİ ÖDEVPEDİA 4
HAFTALIK OLARAK OKUL PLANINA GÖRE O HAFTA İŞLENEN KONULAR İLE ALAKALI OLARAK HAZIRLANAN ÖDEVPEDİA'YA HER ÇARŞAMBA YENİ BİR SAYFA EKLENMEKTEDİR. SİTEDE VAR OLAN BÜTÜN ÇALIŞMALAR OKUL BİLGİLERİNİ PEKİŞTİRME AMAÇLIDIR. BU NEDENLE ÖNCELİK OKUL DERSLERİ VE ÖDEVLERİ OLMALIDIR!

|
|---|
ASİT VE BAZLAR
Maddeler kimyasal özellikleri bakımından üç gruba ayrılır. Bunlar; asitler, bazlar ve asitlik ve bazlık bakımından nötr olan maddelerdir.
ASİTLER
Asitler suda çözündüğünde hidrojen iyonu derişimini arttıran maddelerdir. Hidrojen iyonları çözeltiyi asidik yapar.
Asitlerin Özellikleri;
- Sulu çözeltilerinde H+ iyonu (hidrojen iyonu) verirler.
- Tatları ekşidir.
- Ciltte yanma hissi uyandırırlar. Kuvvetli bir asitse cildi tahriş eder.
- Mavi turnusol kâğıdını kırmızıya çevirirler.
- Sulu çözeltileri elektrik akımını iletir.
- Asitler mermer ve metal yüzeyleri aşındırır. Metal ile tepkimeye girerek H2 gazı açığa çıkarır.
- Asitler, bazlar ile tepkimeye girerek tuz ve su oluştururlar. Buna nötrleşme tepkimesi denir.
Yapısında H (Hidrojen) atomu bulunduran her madde asit değildir. Su (H2O), Amonyak (NH3), Metan gazı (CH4) gibi. Bazı maddeler yapısında ise hidrojen bulunmadığı halde, sulu çözeltilerinde hidrojen iyonu (H+)oluşumuna sebep oldukları için asit özelliği gösterirler. Karbondioksit (CO2), Azot dioksit (NO2) ve Kükürt dioksit (SO2) suda asit özelliği gösteren maddelerdir.
| Formülü | Okunuşu | Suda Çözüldüğünde
Oluşan İyonlar |
Piyasa Adı | Kullanıldığı Yerler |
|---|---|---|---|---|
| HCl | Hidroklorik Asit | H+ ve Cl- | Tuz Ruhu | Temizlik ürünü |
| H2SO4 | Sülfürik Asit | H+ ve SO4-2 | Zaç Yağı | Patlayıcı madde, boya, ilaç ve akü |
| HNO3 | Nitrik Asit | H+ ve NO3- | Kezzap | Patlayıcı madde , gübre ve temizlik ürünü |
| H2CO3 | Karbonik Asit | H+ ve HCO3- | Gazoz Asidi | Gazoz (yağmur suyunda da bulunur.) |
| H3PO4 | Fosforik Asit | H+ ve PO4-3 | Kola Asidi | İlaç, yağ sanayi, sinek ilacı, gıda koruyucu, kola ve temizlik ürünü |
| CH3COOH | Asetik Asit | H+ ve CH3COO- | Sirke | Yemek sektörü |
| HCOOH | Formik Asit | H+ ve HCOO- | Karınca Asidi | koruyucu ve anti bakteriyel alan, deri işleme |
| BAZI YİYECEK VE İÇECEKLERİMİZDEKİ ASİTLER; |
|---|
|
ELMA |
BAZLAR
Baz, suda iyonlaştıklarında ortama OH− (hidroksit) iyonu verebilen maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Suda iyonlaştıklarında hidroksit (OH−) iyonu derişimini arttıran maddelere baz denir.
Bazların Özellikleri;
- Sulu çözeltilerinde OH- (hidroksit) iyonu verirler.
- Tatları acıdır.
- Cilde kayganlık hissi verir.
- Kırmızı turnusol kâğıdını maviye çevirirler.
- Sulu çözeltileri elektrik akımını iletir.
- Metallerle tepkimeye girmemeleri asitlerden ayırmak için kullanılabilir.
- Bazlar; cam, kristal ve porselenleri matlaştırır.
- Bazlar, asitler ile tepkimeye girerek tuz ve su oluştururlar. Buna Nötrleşme tepkimesi denir.
| Formülü | Okunuşu | Suda Çözüldüğünde
Oluşan İyonlar |
Piyasa Adı | Kullanıldığı Yerler |
|---|---|---|---|---|
| NaOH | Sodyum hidroksit | Na+ ve OH- | Kostik | Sabun, lavabo açıcı. |
| KOH | Potasyum hidroksit | K+ ve OH- | Potas Kostik | Arap sabunu, sıvı sabun, şampuan. |
| Ca(OH)2 | Kalsiyum hidroksit | Ca+2 ve OH- | Sönmüş Kireç | Sıva ve harç. |
| Mg(OH)2 | Magnezyum hidroksit | Mg+2 ve OH- | Antiasit | |
| NH3 | Amonyak | NH4+ ve OH- | Amonyak | Ev temizlik malzemesi, gübre, patlayıcı madde |
| LiOH | Lityum Hidroksit | Li+ ve OH- | Pil, Seramik, Cam |
| GÜNLÜK HAYATTA BAZ İÇEREN BAZI MADDELER; |
|---|
|
SABUN DİŞ MACUNU ACI BİBER KABARTMA TOZU ÇİKOLATA KÜL |
Asit ve Bazlar birbirine ters gibi görünse de elektriği iletmek, turnusol kağıdına etki etmek, nötrleşme tepkimesine katılmak gibi ortak yönleri vardır.
BELİRTEÇ (İNDİKATÖR) MADDELER:
pH belirteçleri (İndikatörler), çözeltinin pH'sına bağlı olarak renk değiştiren, karmaşık yapıdaki organik bileşiklerdir. Asidik ve bazik özellik gösteren maddelerde farklı renk alır. Doğal olarak kullanılan belirteçler de vardır.
| Belirteç | Asite uygulandığında aldığı renk | Baza uygulandığında aldığı renk |
|---|---|---|
| Turnusol Kağıdı | Kırmızı | Mavi |
| Metil Oranj | Kırmızı | Sarı |
| Fenolftalein | Renksiz | Pembe |
| Kırmızı Lahana Suyu | Kırmızı | Mavi |
pH ölçeği;
pH ölçeği bir maddenin ne kadar asidik ya da bazik olduğunu belirten ölçektir. 14 birime ayrılmıştır. 0-7 arasındaki değerler asidik, 7 nötr ve 7-14 arası çıkan sonuçlar ise bazik olduğunu gösterir. Farklı bir deyişle çözeltide 0-7 arası H+ iyonları > OH- iyonları, 7 de H+ iyonları = OH- iyonları ve 7-14 arası da H+ iyonları < OH- iyonları denilebilir.
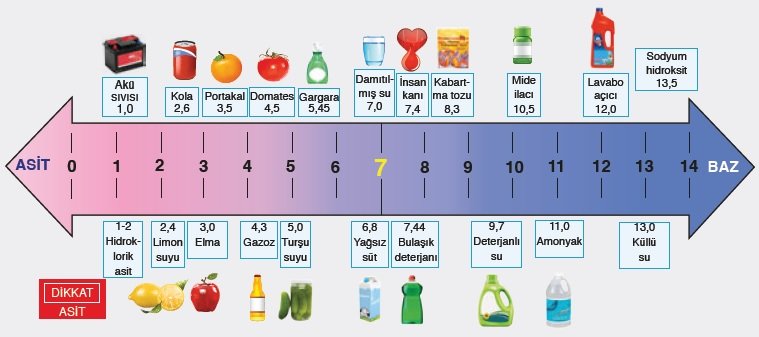
Asit ve Bazların Zararlı Etkisinden Korunma Yolları:
- Mermer tezgahta limon kesmemeliyiz.
- Temizlik sırasında deterjanlı yüzeyleri bol su ile yıkamalıyız.
- Asit ve bazları kullanırken özellikle deterjanların cildimize temasını önlemek için mutlaka eldiven kullanmalıyız.
- Temizlik malzemelerini birbirine rastgele karıştırmamalıyız.
- Labaratuvarda asit ve bazlarla çalışırken mutlaka önlük, koruyucu gözlük ve eldiven kullanmalıyız.
- Herhangi bir kaza anında asit veya bazın temas ettiği bölgeyi bol su ile yıkamalıyız.
- Herhangi bir kaza anında en kısa sürede sağlık kuruluşuna başvurmalıyız.
Asit Yağmuru:
- Fosil yakıtların yanması sonucu CO2, NO2, SO2 gazları açığa çıkar.
- Bu gazlar suda iyonlaşarak H2CO3, HNO3, H2SO4 asitlerini oluşturarak yağmur suyunun asidik özellik oluşturmasına neden olur.
- Oluşan asit yağmuru ormanlara, antik yapılara, şehir yapılarına ve doğaya zarar verir.
- Topraktaki Ca+2 Mg+2 K+ gibi minerallerin çözünmesine neden olarak toprakların verimsizleşmesine neden olur.
- Araçların ve iş makinelerin yüzeyinin aşınmasına neden olur.
- Asit yağmurlarına daha çok hava kirliliği neden olur. Bu yüzden hava kirliliğinin olduğu yerlerde daha sık görülür.
|
|
| AŞAĞIDA YER ALAN KAVRAMLARI, VERİLEN CÜMLELERDE BOŞ BIRAKILAN YERLERE UYGUN ŞEKİLDE YERLEŞTİRİNİZ. | 
|
|---|
| Ekşi | Bazik | Kırmızı | Nötürleşme | Titrasyon | Acı | Limon | Mavi | Asidik |
|---|
| AŞAĞIDA VERİLEN BİLGİLER DOĞRU İSE "D", YANLIŞ ISE "Y" SEÇENEĞİNİ SEÇİNİZ. | 
|
|---|
|
|
| AŞAĞIDAKİ ÇOKTAN SEÇMELİ SORULARI CEVAPLAYINIZ. | 
|
|---|
| TEST |
|---|