ASİT VE BAZLAR
ASİT VE BAZLAR
Maddeler kimyasal özellikleri bakımından üç gruba ayrılır. Bunlar; asitler, bazlar ve asitlik ve bazlık bakımından nötr olan maddelerdir.
ASİTLER
Asitler suda çözündüğünde hidrojen iyonu derişimini arttıran maddelerdir. Hidrojen iyonları çözeltiyi asidik yapar.
Asitlerin Özellikleri;
- Sulu çözeltilerinde H+ iyonu (hidrojen iyonu) verirler.
- Tatları ekşidir.
- Ciltte yanma hissi uyandırırlar. Kuvvetli bir asitse cildi tahriş eder.
- Mavi turnusol kâğıdını kırmızıya çevirirler.
- Sulu çözeltileri elektrik akımını iletir.
- Asitler mermer ve metal yüzeyleri aşındırır. Metal ile tepkimeye girerek H2 gazı açığa çıkarır.
- Asitler, bazlar ile tepkimeye girerek tuz ve su oluştururlar. Buna nötrleşme tepkimesi denir.
Yapısında H (Hidrojen) atomu bulunduran her madde asit değildir. Su (H2O), Amonyak (NH3), Metan gazı (CH4) gibi. Bazı maddeler yapısında ise hidrojen bulunmadığı halde, sulu çözeltilerinde hidrojen iyonu (H+)oluşumuna sebep oldukları için asit özelliği gösterirler. Karbondioksit (CO2), Azot dioksit (NO2) ve Kükürt dioksit (SO2) suda asit özelliği gösteren maddelerdir.
| Formülü | Okunuşu | Suda Çözüldüğünde
Oluşan İyonlar |
Piyasa Adı | Kullanıldığı Yerler |
|---|---|---|---|---|
| HCl | Hidroklorik Asit | H+ ve Cl- | Tuz Ruhu | Temizlik ürünü |
| H2SO4 | Sülfürik Asit | H+ ve SO4-2 | Zaç Yağı | Patlayıcı madde, boya, ilaç ve akü |
| HNO3 | Nitrik Asit | H+ ve NO3- | Kezzap | Patlayıcı madde , gübre ve temizlik ürünü |
| H2CO3 | Karbonik Asit | H+ ve HCO3- | Gazoz Asidi | Gazoz (yağmur suyunda da bulunur.) |
| H3PO4 | Fosforik Asit | H+ ve PO4-3 | Kola Asidi | İlaç, yağ sanayi, sinek ilacı, gıda koruyucu, kola ve temizlik ürünü |
| CH3COOH | Asetik Asit | H+ ve CH3COO- | Sirke | Yemek sektörü |
| HCOOH | Formik Asit | H+ ve HCOO- | Karınca Asidi | koruyucu ve anti bakteriyel alan, deri işleme |
| BAZI YİYECEK VE İÇECEKLERİMİZDEKİ ASİTLER; |
|---|
|
ELMA |
BAZLAR
Baz, suda iyonlaştıklarında ortama OH− (hidroksit) iyonu verebilen maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Suda iyonlaştıklarında hidroksit (OH−) iyonu derişimini arttıran maddelere baz denir.
Bazların Özellikleri;
- Sulu çözeltilerinde OH- (hidroksit) iyonu verirler.
- Tatları acıdır.
- Cilde kayganlık hissi verir.
- Kırmızı turnusol kâğıdını maviye çevirirler.
- Sulu çözeltileri elektrik akımını iletir.
- Metallerle tepkimeye girmemeleri asitlerden ayırmak için kullanılabilir.
- Bazlar; cam, kristal ve porselenleri matlaştırır.
- Bazlar, asitler ile tepkimeye girerek tuz ve su oluştururlar. Buna Nötrleşme tepkimesi denir.
| Formülü | Okunuşu | Suda Çözüldüğünde
Oluşan İyonlar |
Piyasa Adı | Kullanıldığı Yerler |
|---|---|---|---|---|
| NaOH | Sodyum hidroksit | Na+ ve OH- | Kostik | Sabun, lavabo açıcı. |
| KOH | Potasyum hidroksit | K+ ve OH- | Potas Kostik | Arap sabunu, sıvı sabun, şampuan. |
| Ca(OH)2 | Kalsiyum hidroksit | Ca+2 ve OH- | Sönmüş Kireç | Sıva ve harç. |
| Mg(OH)2 | Magnezyum hidroksit | Mg+2 ve OH- | Antiasit | |
| NH3 | Amonyak | NH4+ ve OH- | Amonyak | Ev temizlik malzemesi, gübre, patlayıcı madde |
| LiOH | Lityum Hidroksit | Li+ ve OH- | Pil, Seramik, Cam |
| GÜNLÜK HAYATTA BAZ İÇEREN BAZI MADDELER; |
|---|
|
SABUN DİŞ MACUNU ACI BİBER KABARTMA TOZU ÇİKOLATA KÜL |
Asit ve Bazlar birbirine ters gibi görünse de elektriği iletmek, turnusol kağıdına etki etmek, nötrleşme tepkimesine katılmak gibi ortak yönleri vardır.
BELİRTEÇ (İNDİKATÖR) MADDELER:
pH belirteçleri (İndikatörler), çözeltinin pH'sına bağlı olarak renk değiştiren, karmaşık yapıdaki organik bileşiklerdir. Asidik ve bazik özellik gösteren maddelerde farklı renk alır. Doğal olarak kullanılan belirteçler de vardır.
| Belirteç | Asite uygulandığında aldığı renk | Baza uygulandığında aldığı renk |
|---|---|---|
| Turnusol Kağıdı | Kırmızı | Mavi |
| Metil Oranj | Kırmızı | Sarı |
| Fenolftalein | Renksiz | Pembe |
| Kırmızı Lahana Suyu | Kırmızı | Mavi |
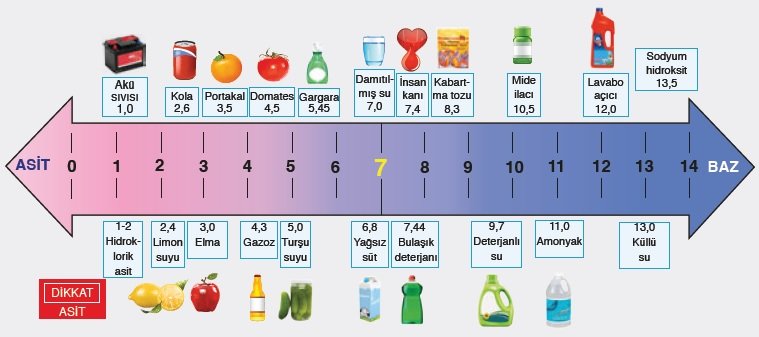
pH ölçeği;
pH ölçeği bir maddenin ne kadar asidik ya da bazik olduğunu belirten ölçektir. 14 birime ayrılmıştır. 0-7 arasındaki değerler asidik, 7 nötr ve 7-14 arası çıkan sonuçlar ise bazik olduğunu gösterir. Farklı bir deyişle çözeltide 0-7 arası H+ iyonları > OH- iyonları, 7 de H+ iyonları = OH- iyonları ve 7-14 arası da H+ iyonları < OH- iyonları denilebilir.
Asit ve Bazların Zararlı Etkisinden Korunma Yolları:
- Mermer tezgahta limon kesmemeliyiz.
- Temizlik sırasında deterjanlı yüzeyleri bol su ile yıkamalıyız.
- Asit ve bazları kullanırken özellikle deterjanların cildimize temasını önlemek için mutlaka eldiven kullanmalıyız.
- Temizlik malzemelerini birbirine rastgele karıştırmamalıyız.
- Labaratuvarda asit ve bazlarla çalışırken mutlaka önlük, koruyucu gözlük ve eldiven kullanmalıyız.
- Herhangi bir kaza anında asit veya bazın temas ettiği bölgeyi bol su ile yıkamalıyız.
- Herhangi bir kaza anında en kısa sürede sağlık kuruluşuna başvurmalıyız.
Asit Yağmuru:
- Fosil yakıtların yanması sonucu CO2, NO2, SO2 gazları açığa çıkar.
- Bu gazlar suda iyonlaşarak H2CO3, HNO3, H2SO4 asitlerini oluşturarak yağmur suyunun asidik özellik oluşturmasına neden olur.
- Oluşan asit yağmuru ormanlara, antik yapılara, şehir yapılarına ve doğaya zarar verir.
- Topraktaki Ca+2 Mg+2 K+ gibi minerallerin çözünmesine neden olarak toprakların verimsizleşmesine neden olur.
- Araçların ve iş makinelerin yüzeyinin aşınmasına neden olur.
- Asit yağmurlarına daha çok hava kirliliği neden olur. Bu yüzden hava kirliliğinin olduğu yerlerde daha sık görülür.