KİMYASAL TEPKİMELER
KİMYASAL TEPKİMELER
Maddelerin kimyasal değişime uğrayarak yeni maddeler oluşturmasına kimyasal tepkime denir. Kimyasal tepkimelerde ısı, ışık, gaz çıkışı, renk değişimi, çökelek oluşumu ve hal değişimi meydana gelebilir. Fakat bu tür değişimler her zaman kimyasal değişim olduğunun kanıtı olamaz. Bazı durumlarda fiziksel değişimlerde de aynı ipuçları görülmektedir.
Elementlerin kararlı hale geçme istekleri:
Elementler kararlı hale geçebilmek için en yakın soy gaza benzemek isterler. Bunun için de elektron alır ya da elektron verirler.1A, 2A ve 3A grubu elementleri (metaller) elektron vererek kararlılığa ulaşır. 5A, 6A, 7A grubu elementleri(ametaller) ise elektron alarak soy gazlara benzerler. Burada önemli olan atomun son yörüngesindeki elektron sayısını tamamlamasıdır. Bir atomda birinci yörünge maksimum 2, ikinci yörünge maksimum 8 elektron alabilir. Son yörüngedeki elektron sayılarını kararlı hale getirmek(soy gazlara benzemek) için başka bir atomla elektron alış verişi yapabilir ( iyonik bağ kurma durumu) ya da başka bir atomla elektronları ortak kullanabilir ( kovalent bağ kurma durumu).
İyon oluşumu: Pozitif veya negatif yükü olan bir atoma ya da atomlar grubuna iyon denir. Son yörüngesinde 1, 2 ve 3 elektron bulunduran atomlar elektron vermeye yatkındırlar. Elektron verdiklerinde (+) değerlik alarak katyon oluştururlar. (Helyum hariç Soygaz olduğu için ) Son yörüngesinde 5,6 ve 7 elektron bulunduranlar elektron almaya yatkındırlar. Elektron aldıklarında (–) değerlik alarak anyon oluştururlar. Bir atom son yörüngesindeki elektron sayısını 2’ye tamamlayarak soy gaza benzer ise bu duruma Dublet Kuralı denir. Bir atomun son yörüngesindeki elektron sayısını 8’e tamamlayarak soy gaza benzemesine ise Oktet Kuralı denir.
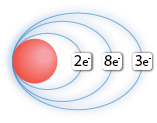
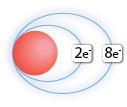
Örneğin; Al ⇒ Al+3 + 3e- Durumuna baktığımızda Alüminyum atomu 3 elektronunu vererek katyon iyonu oluşturmuştur. Normal halde 13 elektronu bulunan Alüminyum atomunun birinci yörüngesinde 2e- ikinci yörüngesinde 8e- ve üçüncü yörüngesinde 3e- bulunurken iyon haline geçtiğinde son yörüngesindeki 3 e- 'nu kaybederek kararlı hale geçer.
| Al Atomu | Al+3 İyonu |
|---|---|
 |
|
Bileşik Formüllerinin Yazılması
İyonik bağlı bileşiklerde daima anyon ve katyon olan iki madde bir araya gelerek bileşik oluşturur. Basit olarak bir örnek verecek olursak Li+ katyonu O-2 anyonu ile bileşik oluşturduğunda Oksijenin 2 elektronunu vereceği iki tane Lityum atomuna ihtiyaç duyar çünkü Lityum sadece bir elektron ihtiyacına sahiptir. Oluşacak bileşik Li2O (lityum oksit) olacaktır.
Li+ ve O-2 ⇒ Li2O
Bir atomun iyon durumunu bilmenin en kolay yöntemi periyodik tablodaki yerini bilmektir. 1A grubu ( Hidrojen hariç ) genellikle +1 değerlikle katyon oluşturur. (Li+, Na+, K+ gibi...) 2A grubu genellikle +2 değerlikle katyon oluşturur. (Be+2, Mg+2, Ca+2 gibi... ) Ametaller sınıfına geçildiğinde ise atom elektron vermektense elektron almanın son yörüngeyi daha kolay kararlı hale getireceğinden elektron almayı tercih eder. 7A Grubu elementleri genellikle -1 değerlilik alarak anyon oluşturur. (Fl-, Cr-, Br- gibi..) 6A Grubu elementleri genellikle -2 değerlilik alarak anyon oluşturur. (O-2, S-2, Se-2 gibi... )
Karşımıza NaOH gibi bir bileşik çıkması durumunda bazı çok atomlu iyonları bilmek durumundayız. Bu bileşikte çok atomlu iyonumuz OH-(hidroksit) iyonudur. Na+ iyonu ile OH- çok atomlu iyonu bir araya gelmiştir.
Na+ ve OH- ⇒ NaOH
Yaygın Görülen Çok Atomlu İyonlar;
|
Hg2+2 |
|---|
Aşağıdaki durumlara dikkat edelim;
Al1durumunda alttaki 1 yazılmaz. Atta bir rakam yoksa biz onu 1 olarak kabul ederiz.- NO3 durumunda 3 oksijen ve 1 azot olmasına karşın Al(NO3)3 durumunda 9(3X3) oksijen 3(1X3) tane azot (N) bulunur.
KİMYASAL BAĞLAR
Kararlı olmayan atomların kararlı hale benzemek için elektron alarak veya vererek ya da elektronlarını ortaklaşa kullanarak oluşturdukları bağa kimyasal bağ denir. Atomlar arasında iyonik ve kovalent bağ olmak üzere iki tür kimyasal bağ oluşur.
| İyonik Bağ | Kovalent Bağ |
|---|---|
| Metal ve ametal atomları arasında oluşur.
Elektron alışverişi gerçekleşir. Elektron veren metal pozitif yüklü iyon (katyon) haline; elektron alan ametal negatif yüklü iyon (anyon) haline gelir. Anyon ve katyon zıt yüklü olduğu için aralarında bir çekim gücü oluşur. İyonik yapı atom yığını ( kristalize ) şeklindedir. İyonik bağlı bileşikler suda iyonlarına ayrışır. İyonik bağlı bileşikler elektrik akımını iletir. Not: Metal atomları sadece iyonik bağ oluştururlar. |
Aynı veya farklı tür ametal atomları arasında oluşur.
Elektron ortaklaşması gerçekleşir. Sadece son katmalardaki elektronlar ortaklaşa kullanılır. Ortaklaşa kullanılan elektronlar, bağ oluşturan atomların katmanlarında dolaşır. Kovalent bağlı bileşikler molekül yapılıdırlar. Sulu çözeltileri elektrik akımını iletmez Not: Ametal atomları hem iyonik hem kovalent bağ oluşturabilir. |
Kimyasal Tepkimelerin Özellikleri
- Madde özelliklerini kaybeder yeni madde oluşur.
- Kimyasal özellikler değişir.
- Atomlar arasındaki kimyasal bağlar kopar.
- Kimyasal tepkimeye giren atomların türü ve sayısı değişmez.
- Kimyasal tepkimeler sırasında madde moleküllerindeki atomları veya iyonları bir arada tutan bağlar kırılır(kopar) ve yeniden düzenlenerek yeni bağlar oluşur.
- Bileşikler kimyasal tepkimeler sonucunda oluşur.
- Canlılarda büyüme, sindirim, solunum, fotosentez gibi olaylar kimyasal tepkimeler sonucu gerçekleşir.
- Kimyasal tepkimeye giren maddenin kütlesi ile ürünleri kütleleri eşittir.
- Girenlerin ve ürünlerin molekül sayısı ve hacimleri korunmayabilir.
Kimyasal Tepkimelerin Yazılması
Kimyasal tepkimeye giren maddeler kimyasal denklemin sol tarafına yazılır ve girenler olarak adlandırılır. Kimyasal tepkime sonucu oluşan maddeler ürün olarak adlandırılır ve kimyasal denklemin sağ tarafına yazılır. Kimyasal tepkimeye birden fazla madde girdiyse giren maddelerin aralarına (+) işareti konur. Aynı durum ürünler için de söz konusudur. Tepkime sonunda birden fazla ürün oluştuysa aralarına (+) işareti konur. ( → ) işareti ise tepkimeye giren maddelerin hangi ürünleri oluşturduğunu göstermek için kullanılır.
GİRENLER → ÜRÜNLER şeklinde oluşacaktır.
KİMYASAL TEPKİMELERİN DENKLEŞTİRİLMESİ
Kimyasal tepkimelere giren maddelerle çıkan maddeleri oluşturan atomların cinsleri ve sayıları aynıdır. Dolayısıyla bir tepkime denkleminin sol ve sağ tarafında aynı cins ve aynı sayıda atom bulunmalıdır. Böyle tepkime denklemlerine denkleştirilmiş tepkime denklemi adı verilir. Eğer bir tepkime denklemi denk değilse, formül ve sembollerin önüne uygun sayılar yazılarak tepkime denkleştirilir.
| DEĞİŞEBİLENLER | DEĞİŞMEYENLER |
|---|---|
| Toplam Molekül Sayısı
Fiziksel Haller Atomların Elektron Düzeni Atomların Elektron Sayısı Fiziksel Özellikler |
Atom Sayısı ve Cinsi
Toplam Kütle Toplam Proton Sayısı Toplam Elektron Sayısı Toplam Nötron Sayısı |
Denkleştirmede dikkat edilmesi gerekenler;
- Denk olmayan atom sayılarının başına kat sayıları yazılarak denkleştirilir.
- Bileşiğin yapısal formülündeki rakamlar değiştirilmez!
- Denkleştirmenin en basit yolu atom sayısı ve çeşidi en fazla bileşiğin katsayısını 1 vermektir. Gerekirse onun da katsayısı değişebilir.
- Hidrojen ve Oksijen atomlarına en son bakılır.
- Bileşiklerin başına kesirli sayı getirilmez. (HCl, BaCl2, H2 CO3 ...)
- Molekül halindeki elementlerin başına kesirli sayı getirilebilir. ( H2, N2, O2 )
Örnek: Fe+O2 → Fe2O3 denklemini inceleyelim.
İlk olarak bakmamız gereken girenler ve ürünlerin ne olduğudur. Burada 1 adet Fe atomu ve 2 tane O atomundan oluşan O2 bileşiği tepkimeye giriyor ve 2 adet Fe, 3 Adet O'den oluşan Fe2O3 (demir oksit) tepkime sonucu oluşuyor.
Oksijen ve hidrojen sona bırakılır o yüzden ilk olarak Fe atomuna bakmalıyız. Bir adet girip 2 adet çıkamayacağı için girenler kısmındaki Fe atomunun başına 2 yazarsak tepkimeye 2 adet Fe sokmuş oluruz. Denklemimiz şu şekli alacaktır;
2Fe+O2 → Fe2O3
Tepkimede olan ikinci atomumuz oksijene baktığımızda 2 adet tepkimeye girmiş fakat 3 adet çıkmış görünmektedir. bu durum söz konusu olamayacağından O2 nin başına 3/2 koymamız gerekecek ve tepkimeye giren oksijen sayısını 3 e çıkarmış olacağız. Böylelikle girenlerde ve ürünlerde eşit sayıda oksijen olmuş olacaktır. Denklemimizin son hali;
2Fe+3/2 O2 → Fe2O3 şeklinde olacaktır.
Kimyasal tepkimeye giren maddelerin toplam kütlesi ile tepkimeden çıkan maddelerin toplam kütleleri birbirine eşittir. Buna kütlenin korunumu kanunu denir. Bir başka değişle madde vardan yok olmaz, yoktan da madde var edilemez.
YANMA TEPKİMESİ
Bir maddenin oksijenle (O2) tepkimeye girmesine yanma denir. Yanma tepkimeleri her zaman çevreye ısı enerjisi yayar ve kendiliğinden devam eder. Bir yanma tepkimesi için; Yanıcı madde, Oksijen (hava) ve Tutuşma Sıcaklığı gerekir. Havasız (O2’siz) ortamda yanma olmaz. Bu nedenle yanan bir maddeyi söndürmek için önce hava ile teması kesmek gerekir. Tüm yanma olayları odunun veya kağıdın yanması gibi bir anda veya alev çıkararak gerçekleşmez. Demirin veya metallerin paslanması da bir yanma olayıdır. Fakat bu olay yavaş yanma adını alır. Aynı zamanda bu olaya oksitlenme de denir. Yanma tepkimeleri sonucu genelde açığa CO2 (karbondioksit) ve su açığa çıkar.